

低碳水饮食与减重
在中国,割席断交第一话题也许是中西医之争。而在国外,近十年的割席断交话题可能要数低碳水与低脂膳食的争论了。其实在胰岛素发明之前,就有人成功运用低碳水膳食来治疗糖尿病、肥胖症和癫痫症。
许多营养师、健康专家以疗效不确定、证据不够充分为由,并不极力推荐低碳水膳食。时至今日,仍有人把低碳水饮食归入所谓的盲从膳食(fad diet)一列。大部分的主流媒体、机构仍旧在强调低脂饮食的作用。

然而过去20年内,越来越多的有力证据表明,低碳水膳食比低脂膳食更为健康,或至少不亚于低脂膳食,包括管控血糖、胰岛素敏感性与减肥等方面。
今年年初美国糖尿病协会(ADA)颁布的《2018糖尿病诊疗标准》以及本月由ADA和欧洲糖尿病研究协会(EASD)共同发布的《2型糖尿病管理共识》中,都认可了低碳水饮食在减重和改善糖尿病方面的潜在效果,尽管将其列入糖尿病或减肥人群的正式膳食指南还需时日。

从理论到实践,需要不断验证与完善。低碳水饮食、减肥、糖尿病、高血脂、高血压…国际上的研究到底进展到何处了?我们离真相还有多远?
我们花费了大量的时间钻研了几乎所有的相关临床文献(文献清单可在文末找到),包括发表在《新英格兰医学杂志》、《营养学》、《糖尿病护理》等权威期刊上的文章,掰开了揉碎了嚼烂了,把数据呈现给所有需要的朋友们,为的是拨开迷雾、理清事实。
01 极简低碳水
顾名思义,低碳水饮食的核心要素就是降低膳食中碳水化合物的总量。时下流行的生酮饮食、地中海饮食以及阿特金斯饮食都属于广义低碳水饮食。它会使人体代谢系统逐渐从糖酵解产能转向寻求从膳食脂肪和人体脂肪中获取能量。

在这一过程中,酮体水平作为替代葡萄糖的能量形式显著提升,血糖波动与胰岛素刺激显著降低,从而产生一系列多通路生化反应,而越来越多的研究认为,这些反应所带来的效果对人体有益。
当碳水摄入不足,同时糖原分解以及糖异生产生的血糖也不足以维持能量供给时,身体会开始分解脂肪形成甘油与游离脂肪酸,后者在肝脏中通过生酮作用转化成乙酰辅酶A这一三大营养物质的代谢中间产物,而后进一步形成三种酮体供能予包括大脑细胞在内的其它细胞。
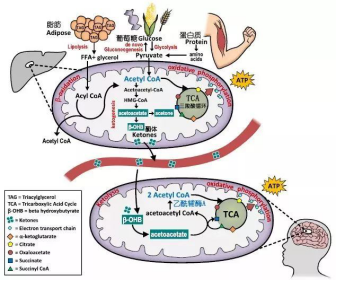
图编自:Gershuni et al., 2018, Curr Nutr Rep. [1]
接下来,我们将回顾分析2000年以来与低碳水膳食相关的临床研究文献,纳入标准包括有对照组、非1型糖尿病研究,标准较为宽泛,旨在排除对文献质量的主观判定,从而能勾画出科学界对低碳水饮食的整体调查结果。
02 多低才算低碳水摄入?
要了解低碳水饮食的功效,首先要理清低碳水饮食的量化定义。目前,国际上并没有对低碳水饮食进行狭义的量化定义,这造成了许多文献、报道中的交流障碍与误会。
根据对2002-2018年34篇临床研究的统计,低碳水的定义范围较广,每日低于130克的碳水化合物摄入,或碳水摄入能量占比低于45%,都可能被认为是低碳水饮食。
如此宽泛的量化范围给普通读者甚至科研人员带来了不小的困惑。于是不少综述文献开始尝试对低碳水的定义进行归纳定量。比官方或者传统膳食指南推荐的碳水摄入更少的饮食即可称为广义的低碳水饮食。
根据摄入量,可分为极低碳水化合物生酮饮食 (Very low carbohydrate (ketogenic) diet,VLC(K)D)、低碳水化合物饮食 (Low carbohydrate diet,LCD)、中碳水化合物饮食 (Moderate carbohydrate diet,MCD)。目前比较流行的生酮饮食与阿特金斯饮食都属于极低碳水摄入范畴。
 (点击图片放大)
(点击图片放大)
按照上图获得较广泛公认的归纳方式,在我们回顾的34篇相关临床文献中,仅有11篇(32%)所执行的饮食方式可算做极低碳水(生酮)饮食,有8篇(24%)的饮食可归为低碳水饮食,多达14篇(44%)中所提倡的饮食只能算是中碳水饮食,甚至有1篇文献所执行的饮食超出了广义低碳水饮食范畴。
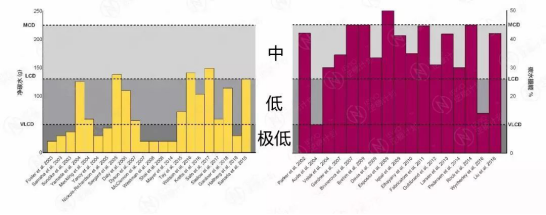
文献中低碳水摄入组的每日碳水摄入量
(单位:克【左】或摄能占比%【右】)
可见,严谨如临床研究文献,所说的“低碳水”也不尽相同。所以,当谈论低碳水时,需要认清楚所述“低碳水”到底有多低,是极低、低还是中碳水。
03 临床结论 – 低碳水饮食能够减肥
低碳水饮食最快速明显的效果之一便是减肥。不管是生酮饮食、阿特金斯饮食还是地中海饮食的拥趸,都坚信以限制(净)碳水摄入为基本逻辑的饮食模式能够让人不再大腹便便。
减肥带来的益处可不仅仅是身材变好,对改善糖尿病、高血脂也是至关重要。
同时,也有一部分人认为,这种效果并不显著,或者说,跟其它减肥饮食相比,并没有太大优势。闲话少叙,我们来看看2000年以来的30余篇临床文献到底是怎么说的。
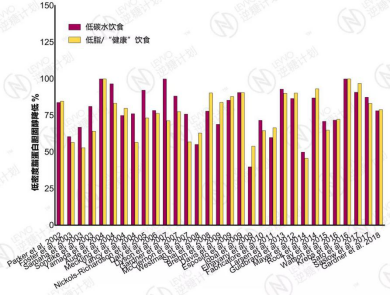
76%(22/29,部分文献未标明组内显著性数据)的研究表明,低碳水饮食在中短期内显著减轻体重,24%的研究认为没有统计学上的显著变化。
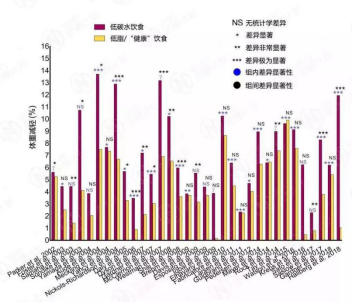
2002年至2018年30篇临床试验报告汇总 – 低碳水饮食在减重方面的优势,试验时长为3个月到2年;当一个研究有多个试验时长时,取最长的(点击图片放大)

同时,过半的研究(52%,17/33)都指向低碳水饮食在减重的效果上要优于低脂饮食或其它遵循健康饮食指南的饮食,48%的研究认为,低碳水饮食与其它饮食方式在减重方面无统计学差别。没有一篇文献认为,低碳水饮食提升体重,或比其它饮食在减重方面更差。
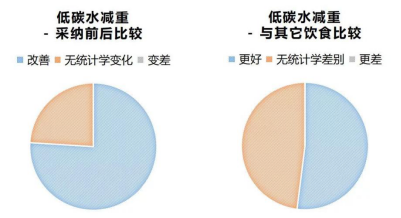
在许多研究的设计中,低碳水组并无热量限制要求,允许患者每次进食达到饱腹,而低脂组通常是限热的。如果仅算腹部脂肪的减少,仍然是低碳水优于低脂。其中,2018年的一项研究表明,低碳水组的一年减重%平均值为12.0%,大大优于低脂组的1.0%。
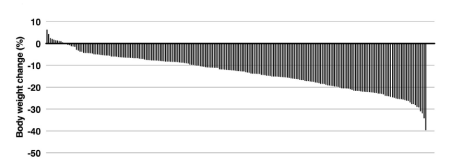
218位采用低碳水饮食患者的减重直方图(Hallberg et al., 2018, Diabetes Ther.)
04 低碳水饮食减肥原理
低碳水饮食减重的原理是多途径的、多尺度的,在此只分析几个核心或者说宏观的解释。在初期,碳水化合物摄入减少,人体会开始消耗存储的糖原以供给能量。
这一“去糖化”的过程将会带来较为明显的减重,要知道,肥胖症患者能存储多达350-500克的肌糖原以及100克的肝糖原。
而每克糖原的代谢都能顺带带走最多达3到4克的水分。这一过程所减掉的体重主要是糖原和水分(所以采纳低碳水饮食需要多补充水分)。
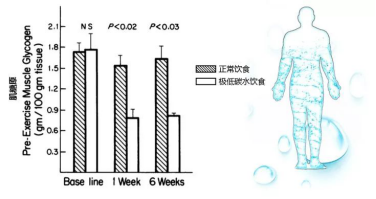
肌糖原储备在极低碳水模式下6周会消耗过半(Bogardus, 1981, J Clin Invest [2])
另一方面,摄入大量碳水化合物会快速升糖进而刺激胰岛素分泌,从而促进脂肪生成。每一次摄入碳水化合物进而升糖、分泌胰岛素都像是在告诉身体:储存脂肪!储存脂肪!
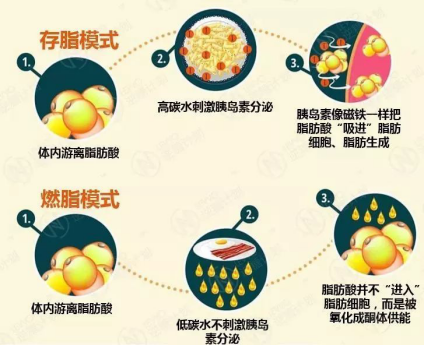
而低碳水膳食使得生成脂肪的大门少了胰岛素这把钥匙,更多的游离脂肪酸被消耗形成酮体 - 一种更为高效与健康的能量形式,身体也将渐渐从糖酵解转变成对脂肪的β氧化方式来供能。
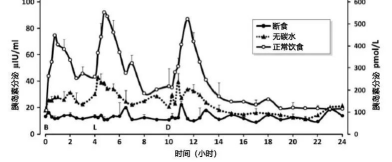
极低碳水(虚线)下胰岛素分泌与断食和标准饮食(实线空点)
的对比(Nuttall et al., 2015, Metab. Clin. Exp.)
控制食欲也是减重的有效途径。刺激瘦素、抑制饥饿素是许多减肥产品的原理。尽管在短期内,低碳水膳食由于抑制了胰岛素从而可能也抑制了瘦素,但随着时间推移,低碳水膳食能间接协同瘦素(leptin)抑制饥饿感。
这其中的机制较为复杂,通过长中效降低瘦素跨越血脑屏障的阻力从而影响下丘脑对食欲的调控是其运作的机理之一 [3]。
同时,大脑对于瘦素的敏感性也会由于低碳水饮食带来的炎症减少而增强,这样单位瘦素的功效等同于被放大了,从而控制了食欲,而且瘦素抵抗的好转所带来的食欲抑制是要超过瘦素量暂减带来的食欲上升[4, 5]。
低碳水饮食通过大幅度改善瘦素抵抗,使得更低水平的瘦素也能更好地控制食欲。而低脂膳食却会升高饥饿素(ghrelin)加强食欲 [6]。
2007年的一项对照试验记录了试验对象的二维饥饿指数(饥饿度与糖瘾指数),发现低碳水饮食组所展现的饥饿指数要显著低于低脂饮食组。
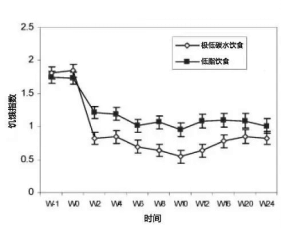
低碳饮食对食欲的控制显著强于低脂饮食(McClernon et al., 2007, Obesity)
同时,低碳水饮食对酪酪肽(peptide YY)水平的控制要优于低脂饮食 [7],酪酪肽是一类抑制食欲的肠道激素。总而言之,低碳水饮食能够通过调控不同的饥饿相关激素控制人的食欲。
这也是为什么即便低碳水饮食不限热,减肥效果也比进行限热的低脂饮食好 – 因为被调查者有着较低的食欲自然而然地少进食了。
另外,低碳水高脂饮食能够磷酸化激活腺苷酸激活蛋白激酶(AMPK)[8],一种对燃烧脂肪等能量代谢起着关键作用的激酶(同时高血糖和高胰岛素抑制AMPK)。AMPK就像身体的总开关,掌控着能量的储存与消耗。
当它被激活的时候,肌细胞会开始充分利用葡萄糖以及燃脂供能从而促进减重。激活AMPK的方式主要包括运动、低碳水高脂饮食、断食以及补充二甲双胍或NAD+(烟酰胺腺嘌呤双核苷酸)前体如烟酸。
需要说明的是,低脂饮食也并不是没有效果,它同样比毫无节制地饮食要好,只不过减重效果远远不如低碳水饮食。
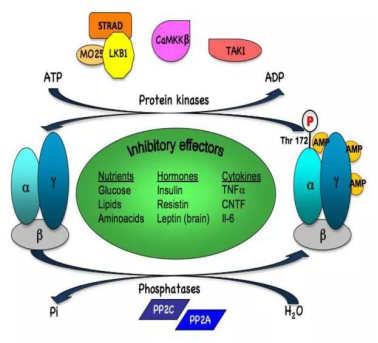
胰岛素是抑制AMPK通路的激素之一
05小 结
大量临床试验表明,低碳水饮食在中短期(3个月到2年)能够带来显著的减重效果,同时比低脂饮食的减重效果更好。其主要原理可简单归纳为四点。
一,消耗冗余糖原同时带走部分水分;
二,减少胰岛素分泌从而抑制脂肪生成;
三,通过调控饥饿素、瘦素等饥饿相关激素来控制食欲;
四,通过激活AMPK通路来燃脂。


二、
低碳水饮食对血糖的改善
01低碳水饮食对2型糖尿病的改善
低碳水膳食减轻甚至逆转2型糖尿病,主要是通过短期到长期控制血糖、中长期内降低胰岛素抗性两个途径。
其中,糖化血红蛋白(HbA1c)是临床上判断2型糖尿病病程的黄金指标。
由于它衡量的是过去2-3个月的平均血糖水平,不受激素、情绪、病变、运动与饮食突变的影响,所以是比单次血糖测量更为合理与科学的判断依据。
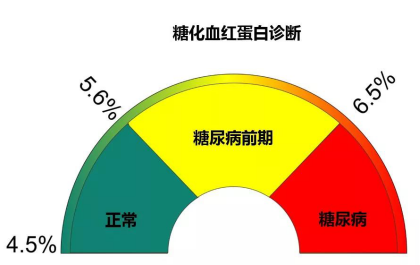
同时,糖化血红蛋白与心脑血管、糖尿病肾炎等并发症发病率的相关性更强,也越来越受到学界的重视。
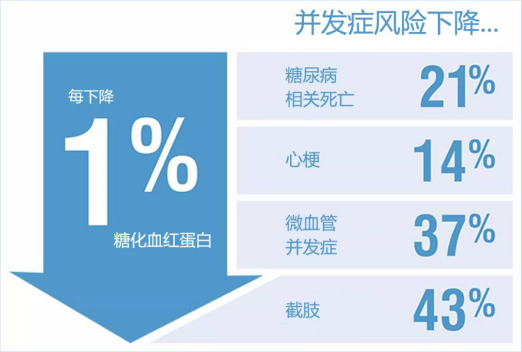
根据对近17年24篇临床试验文献的汇总分析,绝大多数(21/24,88%)的临床试验表明,不论是与高脂、高蛋白或高膳食纤维进行组合,低碳水饮食能够在3个月至2年的时间内显著地降低糖化血红蛋白。
与过去被认为最健康的低脂饮食或是其它饮食指南的推荐饮食模式相比,超过半数(13/24,54%)的临床试验表明,低碳水饮食在降低糖化血红蛋白方面具有显著的优势。
剩下不到半数(46%)的文献声称,两种饮食方式对糖化血红蛋白的影响没有统计学差别。
没有一篇论文得出低脂饮食在降血糖方面要显著地好过低碳水饮食的结论。
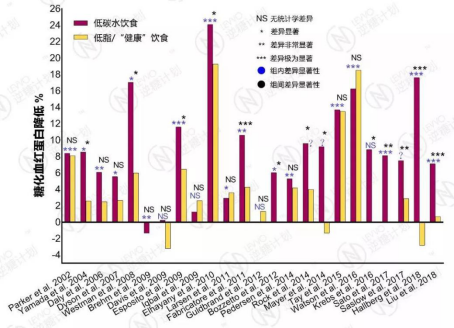
2002年至2018年23篇临床试验报告汇总 – 低碳水饮食在降低糖化血红蛋白HbA1c方面优势明显,试验时长为3个月到2年;负数表示HbA1c值不降反升
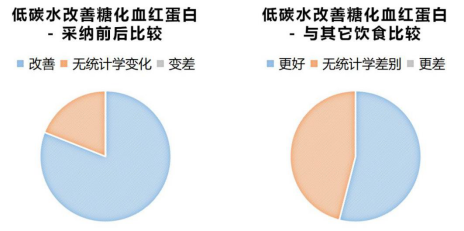
需要指出的是,在低碳水饮食组,由于血糖稳步下降,对医疗干预的减停要普遍多于低脂组。
换句话说,即便比低脂组减少了胰岛素的剂量与降糖药的服用量,其糖化血红蛋白仍旧下降得更多。
这意味着,如果保持医疗干预相同(在临床试验中很难做到),低碳水饮食对于血糖改善的优势将进一步扩大,同时低碳水组的统计学优势显著性也加进一步加强。
02低碳水饮食减轻胰岛素抵抗
糖尿病的诊断标准即为血糖过高,不论是空腹、餐后血糖或是糖化血红蛋白。
尽管高血糖是2型糖尿病的症状或者说是结果而不是根源,但不可否认的是,降低血糖从临床以及病理学上说都是改善2型糖尿病的必经之路。
采纳低碳水膳食直接使人体最大的葡萄糖来源 – 膳食中的净碳水化合物急剧降低,从而降低病患的血糖水平,直接改善其病理指标。
这就像发烧了以后需要退烧,虽然退烧不是真正治愈产生发烧症状的疾病(比如炎症)的方式,但是是一个必经的过程。
血糖下降使得胰岛素分泌也相应减少,而这一关键变化通过多个通路和机理修复了胰岛素抵抗这一2型糖尿病的罪魁祸首。

1.
AMPK降低胰岛素抵抗
首先,低碳水饮食通过激活AMPK通路降低胰岛素抵抗,这一原理类似糖尿病一线药物二甲双胍的作用原理。
AMPK调控负责磷酸化葡萄糖转运蛋白泡囊(GSV)的蛋白质,后者在人体需要使用葡萄糖时会转移至细胞膜上形成运送葡萄糖的渠道 [1]。
AMPK相当于控制着一扇专门运送葡萄糖的任意门,低碳水饮食使得AMPK这个负责葡糖运输的看门大爷工作效率更高了。
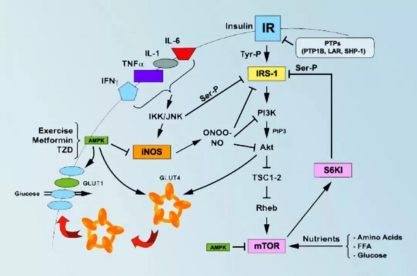
AMPK降低胰岛素抵抗的机理
2. 内脏脂肪加剧胰岛素抵抗
上节提到,过多碳水化合物造成过量的血胰岛素水平,促使葡萄糖储存成内脏脂肪。那么内脏脂肪过多了会如何?想像一下早高峰人头攒动的地铁站。
为了应对客运压力,东京人想出了一个原始粗暴的办法:雇一些地铁推手硬生生地把通勤者推入列车!一个个通勤者就好比葡萄糖分子,列车就好比细胞,而地铁推手就好比胰岛素。

“细胞超载”造成的胰岛素抗性犹如早高峰的东京地铁站 。
编辑自Fung, J. A New Paradigm of Insulin Resistance. Youtube.
当地铁超过运载负荷,越来越多的地铁推手把人推挤至毫无空间,而地铁站上人越来越多,这个时候再多的推手也无用了。
这就是“超载” (Over-flowing) 状态下的胰岛素抵抗,到了这个阶段,“超载”的肝脏变成了脂肪肝,形成肝脏胰岛素抵抗,“超载”的脂肪细胞形成了脂肪胰岛素抵抗,“超载”的肌细胞形成了肌细胞胰岛素抵抗。
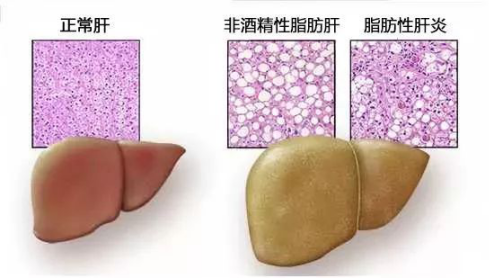
这就像把过多的血糖塞进全身细胞,只不过以脂肪的形式存在。所以2型糖尿病的本质并不只是血液或者尿液含糖过高,而是整个身体含糖过高。
想像一下,当房间(血液)里有过多的垃圾,但像鸵鸟埋首似地把它们丢进水池、浴缸(其它细胞),而不是房子外的垃圾桶(消耗代谢)- 血糖只不过从血液被“塞进”了身体其它地方,你可以视而不见,但很可能(更严重的)2型糖尿病就会不期而至。
更要命的是,长期暴露在高胰岛素水平下的胰岛素受体亲和力[2]与数量[3]也会逐渐下降,直接产生上游的胰岛素抵抗。
03 医疗干预的调整
而对于已经在吃药打针的2型糖尿病患者而言,低碳水饮食可以减少医疗干预,即外源胰岛素以及促泌降糖药(如磺酰脲类、格列奈类)的使用,进一步直接减轻了高胰岛素血症从而减轻胰岛素抵抗。
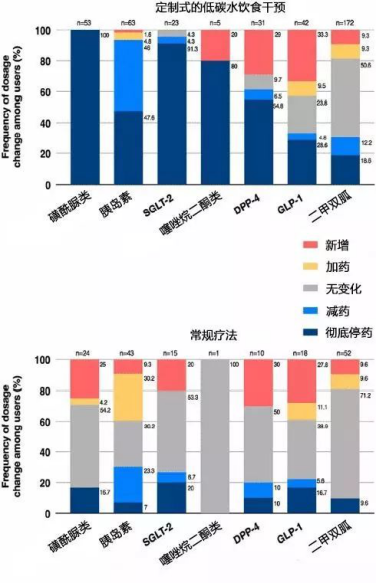
一项临床试验表明,低碳水饮食显著减除医疗干预(Hallberg et al., 2018, Diabetes Ther.)
沿着高碳水-高胰岛素-内脏脂肪-胰岛素抵抗这条简化病理线溯源,可以很直观地得出高碳水饮食是其中的主谋和元凶。
高碳水-胰岛水平导致的肥胖会抑制细胞自噬(autophagy)与亚硝基化谷胱甘肽还原酶(GSNOR)的活性,通过加强内质网应激(ER stress)导致胰岛素敏感性下降[4]。
而激活细胞自噬的调控途径中,抑制哺乳动物雷帕霉素靶蛋白(mTOR)是重要一环,mTOR又与AMPK互相拮抗,这意味着低碳水饮食还能通过AMPK调控细胞自噬与下游胰岛素敏感性。
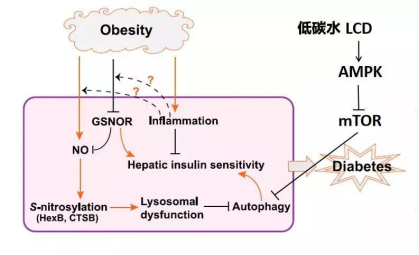
肥胖抑制细胞自噬与GSNOR从而导致胰岛素抵抗(改编自Zhang et al., 2018, Diabetes.)
胰岛素调控葡萄糖利用的途径为PI3K/Akt通路,其中,甘油三酯及其代谢产物通过上调蛋白激酶C的各个亚型(PKC)抑制胰岛素受体底物活性从而下调PI3K/Akt通路信号传递,产生胰岛素抵抗[5]。
04 改善甘油三酯水平
哪种饮食会使得甘油三酯水平在中长期降得更低?
近年来大量研究表明,低碳水高脂或是低脂高碳水饮食,相较于其它宏观营养构成的饮食模式,都会产生更低的血甘油三酯水平,从而降低胰岛素抵抗。
而低碳水高脂饮食减少甘油三酯的程度最甚,吃油得油消耗油、吃糖….得更多油储存油。
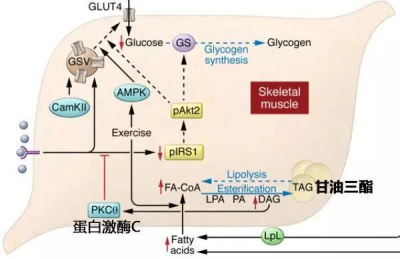
二酰甘油(DAG)介导的PKCθ活性上调导致胰岛素受体底物活性降低,造成肌细胞胰岛素抵抗(Samuel et al., 2016, J. Clin. Investig.)
05低碳水饮食逆转2型糖尿病的机遇?or 挑战?
·相对于减肥人士,2型糖尿病患者采纳低碳水饮食必须做到以下几点。
·全面了解除了血糖指标以外的体检数据,包括肾功、肝功、尿常规、血常规等等。
·找到一系列可以坚持下去的碳水化合物替代食品以及适合糖尿病人的膳食指导。
·基于即时与历史血糖数据,用一种科学安全的方式逐次、梯度式地减除医疗干预,在杜绝低血糖与急需降血糖之间找到一个最优动态平衡。
因此,以低碳水饮食为理论基础,同时找到一套能够科学、高效、安全的定制式管理模式才是打开2型糖尿病逆转大门的正确方式。
06小 结
大多数的研究表明,低碳水饮食在中短期(3个月到2年)能够显著改善糖化血红蛋白,同时比低脂等其它饮食优势明显。
低碳水饮食逆转2型糖尿病的原理包括,直接降血糖、激活AMPK、减轻高胰岛素血症、减少医疗干预、减脂、恢复胰岛素受体亲和力等。
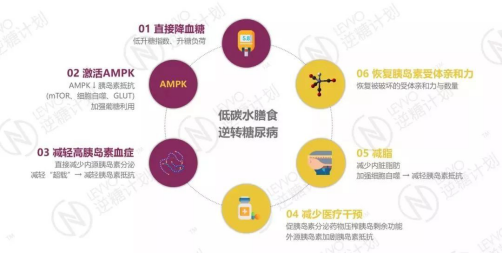
![]()

三、低碳水对血脂的影响
01 血脂与心脑血管疾病
几十年来,脂肪一直被认为是心脑血管疾病的罪魁祸首。这里的脂肪既包括血脂,即血液中的胆固醇与甘油三酯,也指代膳食脂肪,虽然二者完全不同。这是个很庞大繁复、仍存争议的论题,待以后慢慢展开。
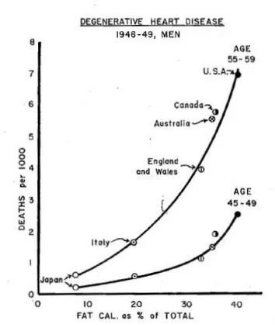
风靡世界60年的低脂浪潮源于“臭名昭著”的七国试验
目前主流科学界认为,如果甘油三酯、小而密的低密度脂蛋白(LDL)水平过高以及高密度脂蛋白(HDL)水平过低,可能会提升心脑血管发病率。

图源: drjockers.com
本篇只阐述其中的冰山一角 ——从膳食脂肪与血脂的关系说起。前面低碳水报告(二)曾经提到,“吃油补油消耗油,吃糖补更多油存更多的油”。这句话里的每一个“油”字所代表的物质都是不一样的。
我们从膳食中摄取的脂肪,在低碳水饮食的条件下,很大一部分最终成为了燃料被消耗掉,而摄入的过多的碳水化合物最后却变成了脂肪细胞里的脂肪,成为肥胖、糖尿病和其它疾病的帮凶。
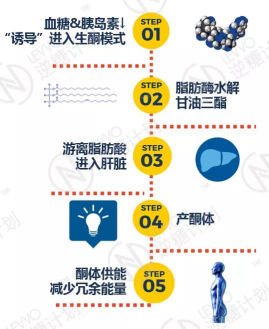
图编自:askdrmatthew.com
02 低碳水饮食降低甘油三酯水平
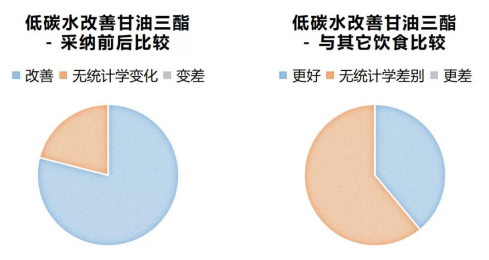
在我们回顾的31篇相关文献中,有29篇(94%)都认为,低碳水饮食能够在3个月到2年间显著降低血甘油三酯水平,仅有两篇(6%)认为没有影响。
有61%(19/31)的文献认为,与低脂或其它“健康”饮食相比,尽管降低甘油三酯的绝对百分比通常要更高,但低碳水饮食在这方面的优势并无统计学显著性。
而剩下的39%(12/31)的文献认为,低碳水饮食要比包括低脂饮食在内的其它饮食更能降低甘油三酯。
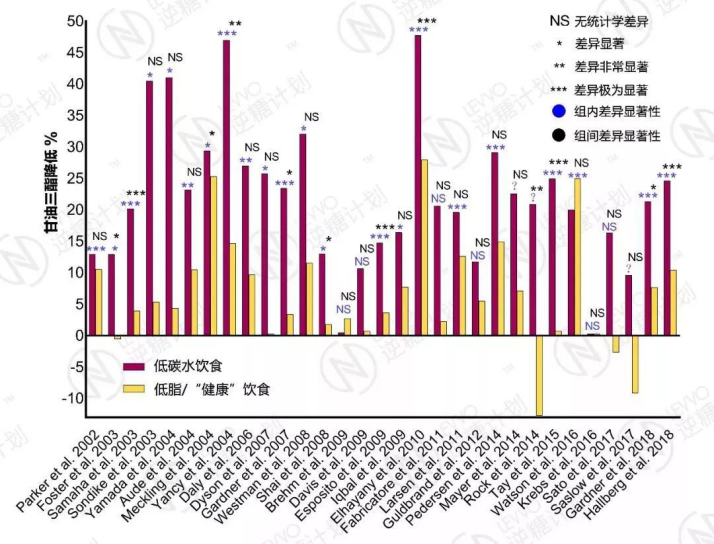
2002年至2018年31篇临床试验报告汇总 – 低碳水饮食在降低甘油三酯方面优势明显,试验时长为3个月到2年;负数表示血甘油三酯水平不降反升;当一个研究有多个试验时长时,取最长的
也就是说,几乎所有的文献都显示,低碳水饮食能够显著地降低甘油三酯,并且与其它推荐饮食相比,效果差别不明显或成效更好。
这个结论似乎与高脂饮食提升血脂(这里指甘油三酯)的直觉背道而驰,也验证了“吃油补油消耗油”的理论。
03 低碳水饮食改善胆固醇总体状况
甘油三酯是过量碳水化合物的存储模式之一,也是能量的存储形式之一,由LDL运输到各个细胞供能,由HDL运输回肝脏进一步回收利用。过高的甘油三酯水平是过量血糖的最直观体现。
适应低碳水饮食后甘油三酯从某种程度上说被当作葡萄糖使用了,自然会逐步降低。而低碳水饮食另一个直观的改变就是改善HDL – 血管清道夫的水平。
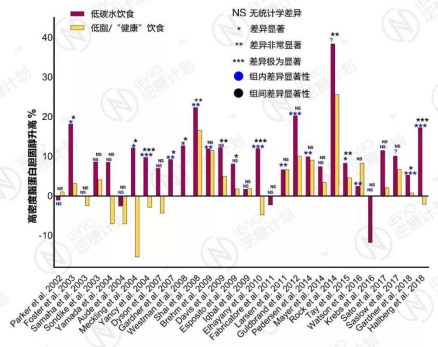
2002年至2018年30篇临床试验报告汇总 – 低碳水饮食在提升HDL方面优势明显,试验时长为3个月到2年;负数表示血HDL水平不升反降;当一个研究有多个试验时长时,取最长的
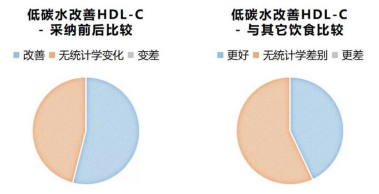
有54%(15/28,有两篇未标明组内显著性数据)的研究表明,低碳水饮食能够在中短期内显著改善HDL水平。
其中,Rock等2014年在《糖尿病护理》(Diabetes Care,影响因子13.4)发表的论文显示,低碳水饮食能够在1年内提升HDL水平高达38% [1]。
剩下的46%的研究表明,改变并不显著。没有一篇文献认为低碳水饮食能显著降低HDL水平。
有57%(17/30)的研究认为,低碳水与其它饮食相比,尽管改善HDL的幅度更高,但并无统计学差异。
43%的研究认为,低碳水比包括低脂饮食在内的其它饮食更能改善HDL水平。没有一篇文献认为低碳水饮食在改善HDL方面比其它任何饮食方式差。
我们再来看看另一个过去被认为是评估心脑血管发病的指标、一号背锅侠 – LDL胆固醇。营养学界对低碳水饮食担忧的一点就是其对LDL的提升。
事实上,低碳水饮食对LDL的改变比我们想像得低得多。
有78%(21/27,有两篇未标明组内显著性数据,一篇不相关)的研究认为,低碳水饮食对LDL水平没有显著的影响。
有15%(4/27)的研究认为,低碳水饮食甚至能显著降低LDL水平,仅仅有2%(2/27)的研究认为低碳水饮食导致了LDL的显著提升。
而与低脂为主的其它膳食模式相比,79%(23/29)的研究表明,两种饮食在改善LDL水平方面没有统计学差异,7%的研究认为低碳水饮食更好,而14%的研究得出相反的结论。
总之,大部分的研究认为,低碳水饮食对LDL没有显著的影响,与其它饮食相比也没有显著的差别。
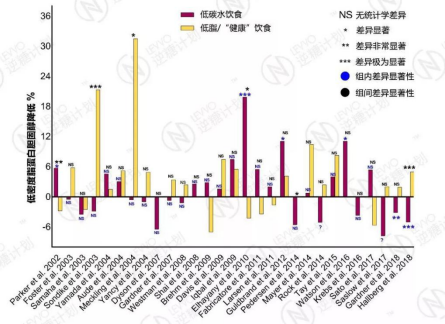
2002年至2018年30篇临床试验报告汇总 – 低碳水饮食对LDL的影响,试验时长为3个月到2年;负数表示血LDL水平不降反升;当一个研究有多个试验时长时,取最长的

事实上,LDL低密度脂蛋白并不是胆固醇,它是血液中胆固醇和甘油三酯的一种运载体,造成血管斑块的起始因素是LDL而不是它所运载的胆固醇。
不幸的是,在中国,大多数时候体检项目测的是LDL-C,也就是LDL中胆固醇的含量。
所谓的好胆固醇HDL和坏胆固醇LDL其实所说的是胆固醇运载体而不是胆固醇。
胆固醇本身并不分好坏,或者说,胆固醇本身并没有问题,在血管发生炎症和损伤时LDL运载着其中的胆固醇去修复,而在这过程中经过一系列的反应可能产生了副作用 – 斑块形成。
而越来越多研究表明,形成斑块的罪魁祸首是那种更容易穿透血管壁的小而密的LDL(Pattern B),而大而松的LDL(Pattern A)并无危害。
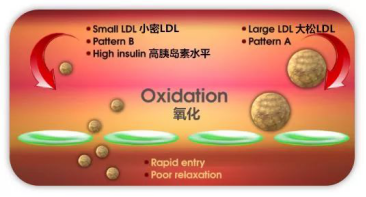
低碳水饮食能够降低这种小密LDL的浓度,所以增加的LDL也多为大松LDL [2]。
其原理简单讲主要是由于低碳水饮食降低甘油三酯与VLDL水平,使得LDL更少地与VLDL产生物质交换而避免趋向富含甘油三酯的LDL,从而避免最终变成小而密的形式。
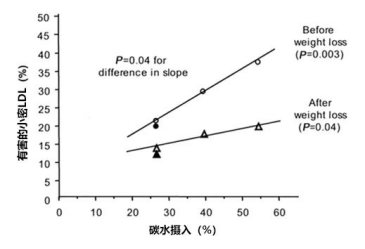
低碳水摄入显著降低小密LDL浓度(Krauss,2006,Am J Clin Nutr)
血脂四项中还有一项,总胆固醇。它对心脏病风险的指导意义不高,现在几乎没有医生单独以它为依据来判断一个病人的患病风险。
总胆固醇包括了HDL与LDL中的胆固醇,其水平的高低并不能反映HDL与LDL的相对浓度,而正如上文所述,胆固醇本身是无辜的。

间隔30年的《时代》周刊封面:左 (1984)– 胆固醇…坏消息;
右(2014) - 吃黄油…科学家把脂肪当作敌人,他们错了。
04小 结
主流科学界仍然认为,过高的血液甘油三酯、小密LDL、与过低的HDL水平更可能导致心脑血管疾病。然而高膳食脂肪完全不能等同于高血脂,相反,低碳水高脂饮食比低脂饮食更能降低血液甘油三酯、提升HDL水平。
同时,多数研究认为,低碳水饮食对LDL水平的提升并不显著,而且主要体现在并无危害的大松LDL粒子上。综上所述,低碳水饮食更有利于防控心脑血管疾病、2型糖尿病等慢性病,从而更应被推广成为防控心脑血管疾病的膳食模式首选。

四、低碳水饮食对血压的影响
和血糖与血脂一道,血压的高低与心脑血管疾病与肾病的发病率有着很强的关联。当血压高于115/75 mmHg时,每升高20/10 mmHg的血压,得心血管疾病的概率都会翻倍。
同时,很容易被忽略的一点是,对于那些血压正常的人来说,更高的血压似乎也与更高的心血管疾病发病率有着关联。
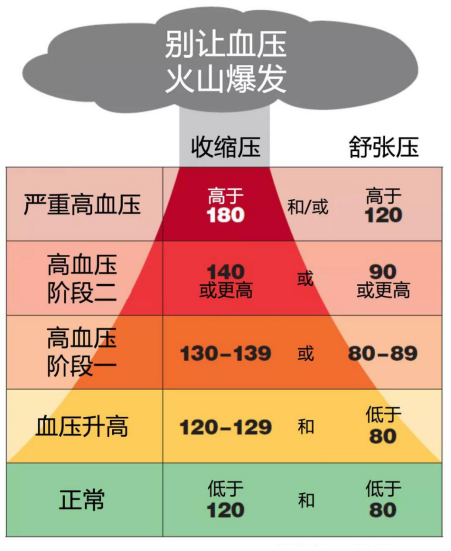
图编自:startwithyourheart.com
也就是说,不管是否罹患高血压,血压低的人(当然不能低至低血压)都比血压高的人更不易患上心血管疾病。
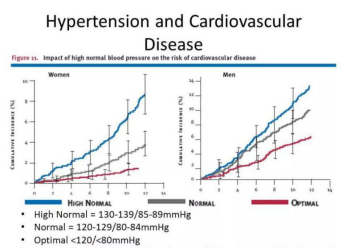
Chobanian et al., 2003, Hypertension [1]
因此,我们需要调查清楚,低碳水饮食是否会对血压指标有着不良影响,抑或是有所改善。
01 低碳水膳食对血压的影响
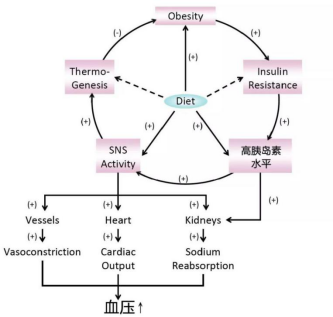
胰岛素抵抗与高胰岛素水平加剧高血压(Huang et al., 2012, Cardiomyopathies)
有63%/58%的研究表明,低碳水饮食对收缩压/舒张压有显著改善,有37%/42%的研究认为,低碳水饮食对收缩压/舒张压并没有明显的影响,没有一项研究的结果表明,低碳水饮食会显著升高血压。
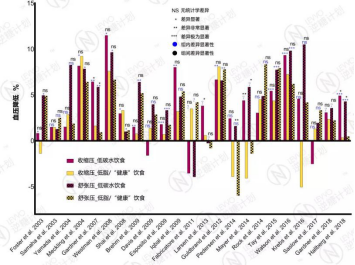
2002年至2018年临床试验报告汇总 – 低碳水饮食在降血压方面的疗效对比,
试验时长为3个月到2年;负数表示血压不降反升;
当一个研究有多个试验时长时,取最长的
然而,血压的影响因素较多,低碳饮食对血压的影响并不像对血糖与血脂的影响那么直接。因此,与低碳水饮食对血糖、血脂与体重的改善优势相比,其对血压的改善并不比低脂或其它饮食有显著的优势。
仅有17%的研究得出低碳水显著地比低脂/其它饮食更能降血压,剩下的83%的研究结果表明,两者并没有统计学差别。仍然没有一篇论文认为,低碳水饮食在改善血压方面比低脂/其它饮食差。
小结:通过改善胰岛素抵抗与高胰岛素血症,低碳水饮食对血压的影响总体上是积极的。低碳水饮食有可能改善血压,至少不会恶化。低碳水饮食与低脂等其它特殊饮食对血压的影响没有太大差别。
02 低碳水膳食也许更易坚持
我们很难百分百客观地评价某种饮食的坚持难易程度,这个命题本身就掺杂了许多主观因素。
对于个人来说,大概只有两种方式去相对直接地评判:自己试一试或者调查临床试验的依从性。
根据我们的统计,54.8%(17/31)的研究表明低碳水膳食的试验完成率高过其它膳食方式(以低脂膳食为主)。
41.9%(13/31)的研究表明低碳水膳食的试验完成率不如其它膳食方式,有一项研究表明两种饮食方式完成率一样。
退出试验的原因包括,发生不适症状、失去信心、失去兴趣、无法坚持饮食、失联、搬迁、个人/家庭因素、意外事件等等。
其中只有发生不适症状与无法坚持饮食两项数据是能够直接反映对某种饮食坚持难易度的。
然而,大多数试验并未给出细分的退出理由分布。但是各研究的试验完成度能够从侧面反映,低碳水饮食至少不比以低脂为主的饮食模式更难坚持。
但另一方面,文献中的试验人群绝大部分为非亚裔人种,他们的饮食结构和国人相去甚远,目前仍然缺少足够的研究论证,中国人对调整膳食结构中宏观营养元素的依从情况。
试验完成率对比;大部分研究并未给出显著性数据
03 低碳水饮食快问快答
以下对低碳水饮食的相关问题做一个简单的FAQ回复,大家可以继续关注Levvo逆糖计划公众号获取更详尽的信息。
·低碳水饮食是否会造成酮酸中毒?
Re:不会。最严格的低碳水饮食也很难让血酮超过3 mmol/L,0.5-3 mmol/L的范围处于营养性生酮范畴(Nutritional ketosis),而酮症酸中毒的阈值为10 mmol/L以上。然而,1型糖尿病和脂肪代谢失调患者需要注意。
·低碳水饮食是否会造成乏力犯困等现象?
Re:有可能。这一阶段称之为Keto flu,暂且称它为生酮不适,是由于身体获能的来源从葡萄糖变为了脂肪,我们的身体需要重新适应。这一阶段长短不一,因人而异。
·低碳水饮食是否会造成肌肉流失?
Re:在初期,也就是Keto flu阶段,身体需要额外的糖异生来供能,这个过程可能会导致少量的肌肉流失。但随着身体适应了新的供能模式,开始大量燃脂获能,便不会打肌肉的主意。
所以健身的朋友不用怕,石头强森、金刚狼杰克曼、勒布朗詹姆斯会告诉你应该是怎么吃的。PS:适当恢复部分碳水以激活mTor通路加强蛋白质合成对健身人士来说不会有大影响。

三位践行低碳水饮食的肌肉男
·践行低碳水饮食似乎有点贵?
Re:是也不是。碳水化合物那么流行当然有它的经济学道理 – 便宜。但是考虑到低碳水饮食带来的诸多健康益处,而这些需要多少钱换来呢?
·低碳水饮食是否适用于所有人?
Re:不是的。请看下文“局限与声明”的第7条。
·既然低碳水饮食这么健康,为什么膳食指南不是这么写的?
Re:因为膳食指南不是我写的:)开个玩笑,这个问题艰深。我们也许会写一篇这样的文章,正在小心地组织语言。敬请关注。
·低碳水饮食对运动能力的影响?
Re:一些研究表明,低碳水饮食可能在中短期提高有氧能力,略微降低无氧能力。然而证据有限、存争议。
一些职业运动员开始使用Train low, compete high的方式,即训练时低碳水、比赛时爆碳水以提高高强度供能效率。
·采纳低碳水饮食会变傻吗?
Re:不会。没有证据显示低碳水饮食会让人反应迟钝、智商下降。相反,它能让人更容易集中精力,也有证据表明,低碳水饮食与降低帕金森、阿兹海默症发病率有一定关系。
04 后记
这是低碳水系列报告的最终篇,也是逆糖计划继续探索下去的起点。
局限与声明
1. 本文中提到的低碳水为广义的低碳水,即比普通膳食的碳水摄入低的饮食方式,但它包含了狭义低碳水饮食中的低-中碳水饮食。
2. 绝大部分的临床试验都在两年以内,更长时限的临床试验目前还比较少见。绝大多数的临床试验表明,低碳水饮食在中短期内的效果更好,而随着时间的推移,各实验组的膳食结构趋向相同,换句话说,不管是何种饮食,其依从性一般是慢慢下降的,对于有改善还是未改善的人来说都是这样。
可以理解为,好转了就懈怠了,没有好转就放弃了 - 人之本性如此。因此,怎样提升患者依从性极为关键,依从性在健康管理中就是木桶理论的短板,没有良好的依从性,再优质的理论、产品和管理模式都可能是无效的。
3. 在一些试验中,低脂组也得到了显著的改善,只不过大多数情况下不如低碳水组的改善程度大。可以确定的是,低脂饮食不如我们想像得那么健康,但也并不能得出低脂饮食一无是处的结论。
4. 本文并未对各研究之间的样本量差异进行权重分析,只是直观地罗列近十年学界对低碳水饮食相关研究的汇总。
5. 本文旨在客观阐述、分析科学界对低碳水饮食的相关研究,对于结论背后的机理并未深入探讨。
6. 尽管我们竭尽所能阅读了尽可能多的文献,但一定还有漏网之鱼,特别是为了比较其它饮食与低碳水饮食的差别,我们并没有纳入那些没有对照组的临床,而这些研究也是有一定价值的。
本文也许是中文科普类文章中对于低碳水饮食研究较为全面的,但一定不是绝对完整的。
7. 低碳水饮食的不适应人群包括但不限于,心脑血管疾病患者(心梗、中风、心衰等)、肝胆病患者(酒精性脂肪肝、肝功异常、胆结石等)、肾病(肾衰竭、肾结石等)、有酮酸中毒史人群、代谢失调症患者、癌症患者、备孕怀孕者等。
8. 许多其它论点本系列文章阐述未尽,包括低碳水饮食对尿酸、肾功、炎症的影响、与低碳水饮食相关的经济学、社会学探讨等等。
9. 利益攸关:本文作者为低碳水饮食倡导者。
临床文献汇集:
Parker B, Noakes M, Luscombe N, Clifton P. Effect of a high-protein, high–monounsaturated fat weight loss diet on glycemic control and lipid levels in type 2 diabetes. Diabetes care. 2002 Mar 1;25(3):425-30.
Foster GD, Wyatt HR, Hill JO, McGuckin BG, Brill C, Mohammed BS, Szapary PO, Rader DJ, Edman JS, Klein S. A randomized trial of a low-carbohydrate diet for obesity. New England Journal of Medicine. 2003 May 22;348(21):2082-90.
Samaha FF, Iqbal N, Seshadri P, Chicano KL, Daily DA, McGrory J, Williams T, Williams M, Gracely EJ, Stern L. A low-carbohydrate as compared with a low-fat diet in severe obesity. New England Journal of Medicine. 2003 May 22;348(21):2074-81.
Sondike SB, Copperman N, Jacobson MS. Effects of a low-carbohydrate diet on weight loss and cardiovascular risk factor in overweight adolescents. The Journal of pediatrics. 2003 Mar 1;142(3):253-8.
Yamada Y, Uchida J, Izumi H, Tsukamoto Y, Inoue G, Watanabe Y, Irie J, Yamada S. A non-calorie-restricted low-carbohydrate diet is effective as an alternative therapy for patients with type 2 diabetes. Internal medicine. 2014;53(1):13-9.
Aude YW, Agatston AS, Lopez-Jimenez F, Lieberman EH, Almon M, Hansen M, Rojas G, Lamas GA, Hennekens CH. The national cholesterol education program diet vs a diet lower in carbohydrates and higher in protein and monounsaturated fat: a randomized trial. Archives of internal medicine. 2004 Oct 25;164(19):2141-6.
Meckling KA, O’sullivan C, Saari D. Comparison of a low-fat diet to a low-carbohydrate diet on weight loss, body composition, and risk factors for diabetes and cardiovascular disease in free-living, overweight men and women. The Journal of Clinical Endocrinology & Metabolism. 2004 Jun 1;89(6):2717-23.
Yancy WS, Olsen MK, Guyton JR, Bakst RP, Westman EC. A low-carbohydrate, ketogenic diet versus a low-fat diet to treat obesity and hyperlipidemia: a randomized, controlled trial. Annals of internal medicine. 2004 May 18;140(10):769-77.
Nickols-Richardson SM, Coleman MD, Volpe JJ, Hosig KW. Perceived hunger is lower and weight loss is greater in overweight premenopausal women consuming a low-carbohydrate/high-protein vs high-carbohydrate/low-fat diet. Journal of the American Dietetic Association. 2005 Sep 1;105(9):1433-7.
Daly ME, Paisey R, Paisey R, Millward BA, Eccles C, Williams K, Hammersley S, MacLeod KM, Gale TJ. Short‐term effects of severe dietary carbohydrate‐restriction advice in Type 2 diabetes—a randomized controlled trial. Diabetic Medicine. 2006 Jan;23(1):15-20.
Dyson PA, Beatty S, Matthews DR. A low‐carbohydrate diet is more effective in reducing body weight than healthy eating in both diabetic and non‐diabetic subjects. Diabetic Medicine. 2007 Dec;24(12):1430-5.
Gardner CD, Kiazand A, Alhassan S, Kim S, Stafford RS, Balise RR, Kraemer HC, King AC. Comparison of the Atkins, Zone, Ornish, and LEARN diets for change in weight and related risk factors among overweight premenopausal women: the A TO Z Weight Loss Study: a randomized trial. Jama. 2007 Mar 7;297(9):969-77.
McClernon FJ, Yancy Jr WS, Eberstein JA, Atkins RC, Westman EC. The effects of a low‐carbohydrate ketogenic diet and a low‐fat diet on mood, hunger, and other self‐reported symptoms. Obesity. 2007 Jan;15(1):182-.
Westman EC, Yancy WS, Mavropoulos JC, Marquart M, McDuffie JR. The effect of a low-carbohydrate, ketogenic diet versus a low-glycemic index diet on glycemic control in type 2 diabetes mellitus. Nutrition & metabolism. 2008 Dec;5(1):36.
Shai I, Schwarzfuchs D, Henkin Y, Shahar DR, Witkow S, Greenberg I, Golan R, Fraser D, Bolotin A, Vardi H, Tangi-Rozental O. Weight loss with a low-carbohydrate, Mediterranean, or low-fat diet. New England Journal of Medicine. 2008 Jul 17;359(3):229-41.
Brehm BJ, Lattin BL, Summer SS, Boback JA, Gilchrist GM, Jandacek RJ, D’alessio DA. One-year comparison of a high–monounsaturated fat diet with a high-carbohydrate diet in type 2 diabetes. Diabetes Care. 2009 Feb 1;32(2):215-20.
Davis NJ, Tomuta N, Schechter C, Isasi CR, Segal-Isaacson CJ, Stein D, Zonszein J, Wylie-Rosett J. Comparative study of the effects of a 1-year dietary intervention of a low-carbohydrate diet versus a low-fat diet on weight and glycemic control in type 2 diabetes. Diabetes care. 2009 Jul 1;32(7):1147-52.
Esposito K, Maiorino MI, Ciotola M, Di Palo C, Scognamiglio P, Gicchino M, Petrizzo M, Saccomanno F, Beneduce F, Ceriello A, Giugliano D. Effects of a Mediterranean-style diet on the need for antihyperglycemic drug therapy in patients with newly diagnosed type 2 diabetes: a randomized trial. Annals of internal medicine. 2009 Sep 1;151(5):306-14.
Iqbal N, Vetter ML, Moore RH, Chittams JL, Dalton‐Bakes CV, Dowd M, Williams‐Smith C, Cardillo S, Wadden TA. Effects of a low‐intensity intervention that prescribed a low‐carbohydrate vs. a low‐fat diet in obese, diabetic participants. Obesity. 2010 Sep;18(9):1733-8.
Elhayany A, Lustman A, Abel R, Attal‐Singer J, Vinker S. A low carbohydrate Mediterranean diet improves cardiovascular risk factors and diabetes control among overweight patients with type 2 diabetes mellitus: a 1‐year prospective randomized intervention study. Diabetes, Obesity and Metabolism. 2010 Mar;12(3):204-9.
Fabricatore AN, Wadden TA, Ebbeling CB, Thomas JG, Stallings VA, Schwartz S, Ludwig DS. Targeting dietary fat or glycemic load in the treatment of obesity and type 2 diabetes: a randomized controlled trial. Diabetes research and clinical practice. 2011 Apr 1;92(1):37-45.
Guldbrand H, Dizdar B, Bunjaku B, Lindström T, Bachrach-Lindström M, Fredrikson M, Östgren CJ, Nystrom FH. In type 2 diabetes, randomisation to advice to follow a low-carbohydrate diet transiently improves glycaemic control compared with advice to follow a low-fat diet producing a similar weight loss. Diabetologia. 2012 Aug 1;55(8):2118-27.
Larsen RN, Mann NJ, Maclean E, Shaw JE. The effect of high-protein, low-carbohydrate diets in the treatment of type 2 diabetes: a 12 month randomised controlled trial. Diabetologia. 2011 Apr 1;54(4):731-40.
Pedersen E, Jesudason DR, Clifton PM. High protein weight loss diets in obese subjects with type 2 diabetes mellitus. Nutrition, Metabolism and Cardiovascular Diseases. 2014 May 1;24(5):554-62.
Mayer SB, Jeffreys AS, Olsen MK, McDuffie JR, Feinglos MN, Yancy Jr WS. Two diets with different haemoglobin A1c and antiglycaemic medication effects despite similar weight loss in type 2 diabetes. Diabetes, Obesity and Metabolism. 2014 Jan;16(1):90-3.
Rock CL, Flatt SW, Pakiz B, Taylor KS, Leone AF, Brelje K, Heath DD, Quintana EL, Sherwood NE. Weight loss, glycemic control, and cardiovascular disease risk factors in response to differential diet composition in a weight loss program in type 2 diabetes: a randomized controlled trial. Diabetes care. 2014 Apr 22:DC_132900.
Tay J, Luscombe-Marsh ND, Thompson CH, Noakes M, Buckley JD, Wittert GA, Yancy Jr WS, Brinkworth GD. Comparison of low-and high-carbohydrate diets for type 2 diabetes management: a randomized trial, 4. The American journal of clinical nutrition. 2015 Jul 29;102(4):780-90.
Watson N, Dyer K, Buckley J, Brinkworth G, Coates A, Parfitt G, Howe P, Noakes M, Murphy K. Effects of low-fat diets differing in protein and carbohydrate content on cardiometabolic risk factors during weight loss and weight maintenance in obese adults with type 2 diabetes. Nutrients. 2016 May 12;8(5):289.
Krebs JD, Strong AP, Cresswell P, Reynolds AN, Hanna A, Haeusler S. A randomised trial of the feasibility of a low carbohydrate diet vs standard carbohydrate counting in adults with type 1 diabetes taking body weight into account. Asia Pacific journal of clinical nutrition. 2016 Jan 21;25(1):78-84.
Sato J, Kanazawa A, Makita S, Hatae C, Komiya K, Shimizu T, Ikeda F, Tamura Y, Ogihara T, Mita T, Goto H. A randomized controlled trial of 130 g/day low-carbohydrate diet in type 2 diabetes with poor glycemic control. Clinical Nutrition. 2017 Aug 1;36(4):992-1000.
Saslow LR, Daubenmier JJ, Moskowitz JT, Kim S, Murphy EJ, Phinney SD, Ploutz-Snyder R, Goldman V, Cox RM, Mason AE, Moran P. Twelve-month outcomes of a randomized trial of a moderate-carbohydrate versus very low-carbohydrate diet in overweight adults with type 2 diabetes mellitus or prediabetes. Nutrition & diabetes. 2017 Dec 21;7(12):304.
Gardner CD, Trepanowski JF, Del Gobbo LC, Hauser ME, Rigdon J, Ioannidis JP, Desai M, King AC. Effect of low-fat vs low-carbohydrate diet on 12-month weight loss in overweight adults and the association with genotype pattern or insulin secretion: the DIETFITS randomized clinical trial. Jama. 2018 Feb 20;319(7):667-79.
Hallberg SJ, McKenzie AL, Williams PT, Bhanpuri NH, Peters AL, Campbell WW, Hazbun TL, Volk BM, McCarter JP, Phinney SD, Volek JS. Effectiveness and safety of a novel care model for the management of type 2 diabetes at 1 year: an open-label, non-randomized, controlled study. Diabetes Therapy. 2018 Apr 1;9(2):583-612.
Liu K, Wang B, Zhou R, Lang HD, Ran L, Wang J, Li L, Kang C, Zhu XH, Zhang QY, Zhu JD. Effect of combined use of a low-carbohydrate, high-protein diet with omega-3 polyunsaturated fatty acid supplementation on glycemic control in newly diagnosed type 2 diabetes: a randomized, double-blind, parallel-controlled trial. The American journal of clinical nutrition. 2018 Aug 1;108(2):256-65.
参考文献:
(一)减重篇
1. Gershuni, V.M., S.L. Yan, and V. Medici, Nutritional Ketosis for Weight Management and Reversal of Metabolic Syndrome. Current nutrition reports, 2018: p. 1-10.
2. Bogardus, C., et al., Comparison of carbohydrate-containing and carbohydrate-restricted hypocaloric diets in the treatment of obesity. Endurance and metabolic fuel homeostasis during strenuous exercise. The Journal of clinical investigation, 1981. 68(2): p. 399-404.
3. Banks, W.A., et al., Triglycerides induce leptin resistance at the blood-brain barrier. Diabetes, 2004. 53(5): p. 1253-1260.
4. de Git, K. and R. Adan, Leptin resistance in diet‐induced obesity: the role of hypothalamic inflammation. Obesity reviews, 2015. 16(3): p. 207-224.
5. Forsythe, C.E., et al., Comparison of low fat and low carbohydrate diets on circulating fatty acid composition and markers of inflammation. Lipids, 2008. 43(1): p. 65-77.
6. Sumithran, P., et al., Ketosis and appetite-mediating nutrients and hormones after weight loss. European journal of clinical nutrition, 2013. 67(7): p. 759.
7. Hu, T., et al., The effects of a low-carbohydrate diet on appetite: A randomized controlled trial. Nutrition, Metabolism and Cardiovascular Diseases, 2016. 26(6): p. 476-488.
8. Draznin, B., et al., Effect of dietary macronutrient composition on AMPK and SIRT1 expression and activity in human skeletal muscle. Hormone and Metabolic Research, 2012. 44(09): p. 650-655.
(二)血糖篇
1. O'Neill, H.M., et al., AMP-activated protein kinase (AMPK) β1β2 muscle null mice reveal an essential role for AMPK in maintaining mitochondrial content and glucose uptake during exercise. Proceedings of the National Academy of Sciences, 2011. 108(38): p. 16092-16097.
2. De Meyts, P., et al., Insulin interactions with its receptors: experimental evidence for negative cooperativity. Biochemical and biophysical research communications, 1973. 55(1): p. 154-161.
3. Gavin, J.R., et al., Insulin-dependent regulation of insulin receptor concentrations: a direct demonstration in cell culture. Proceedings of the National Academy of Sciences, 1974. 71(1): p. 84-88.
4. Qian, Q., et al., S-Nitrosoglutathione reductase dysfunction contributes to obesity-associated hepatic insulin resistance via regulating autophagy. Diabetes, 2017: p. db170223.
5. Samuel, V.T. and G.I. Shulman, The pathogenesis of insulin resistance: integrating signaling pathways and substrate flux. The Journal of clinical investigation, 2016. 126(1): p. 12-22.
(三)血脂篇
1. Rock, C.L., et al., Weight loss, glycemic control, and cardiovascular disease risk factors in response to differential diet composition in a weight loss program in type 2 diabetes: a randomized controlled trial. Diabetes care, 2014: p. DC_132900.
2. Krauss, R.M., et al., Separate effects of reduced carbohydrate intake and weight loss on atherogenic dyslipidemia–. The American journal of clinical nutrition, 2006. 83(5): p. 1025-1031.
(四)血压篇
1. Chobanian, A.V., et al., Seventh report of the joint national committee on prevention, detection, evaluation, and treatment of high blood pressure. hypertension, 2003. 42(6): p. 1206-1252.
2. Huang, J.-P. and L.-M. Hung, Insulin resistance and cardiomyopathy, in Cardiomyopathies-From Basic Research to Clinical Management. 2012, InTech.